
▲清華大學生科系教授王雯靜與博士後研究員陳粲然首次解析癌細胞關鍵蛋白「結構開關」的運作機制。 (圖/記者蔣彤雲攝)
【亞太新聞網/記者蔣彤雲/新竹報導】
抗氧化劑一向被認為是保護細胞、維持健康的重要角色,但國立清華大學生命科學系教授王雯靜研究團隊最新發現,人體內常見的抗氧化物「穀胱甘肽(GSH)」,在癌細胞中具有更為複雜的作用,甚至可能成為幫助癌細胞活下來的關鍵因素,這項研究展示一條影響癌細胞生存的重要代謝路徑,並提出可誘導癌細胞自我崩解的策略,成果已刊登於國際頂尖期刊《Advanced Science》,為癌症治療帶來嶄新思維。
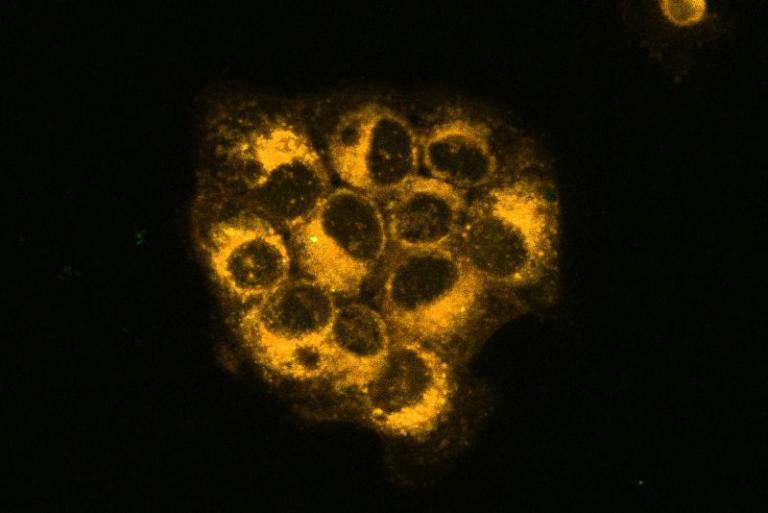
▲在倒立螢光顯微鏡下,能清楚看見癌細胞脂質的氧化壓力、確認鐵死亡狀況。 (圖/記者蔣彤雲攝)
研究發現,穀胱甘肽不僅能幫助細胞抵抗氧化壓力,還會與一種名為「丙酮酸激酶M2(PKM2)」的關鍵代謝酵素結合,使其維持在最活躍的「四聚體」狀態。丙酮酸激酶M2就像細胞能量的開關,直接影響癌細胞是否能快速獲取能量與合成原料,以支撐其持續生長。
王雯靜以駕駛車輛比喻,當癌細胞一方面失去穀胱甘肽的保護,另一方面卻又被迫讓丙酮酸激酶M2持續高速運轉,就像同時面臨「剎車失靈」和「油門加速」的雙重打擊,最終因代謝失衡而承受過高的脂質氧化壓力,進而啟動一種稱為「鐵死亡(ferroptosis)」的自我崩解機制。在動物實驗中,這項策略已成功抑制腫瘤的生長
。

▲清華研究團隊透過蛋白質晶體繞射實驗,發現抗氧化劑的雙面性。(圖/記者蔣彤雲攝)
研究第一作者陳粲然表示,細胞能量代謝酵素的活性受到相當複雜的調控機制影響,研究團隊透過一系列篩選和結構生物學分析,成功發現新的調控機制,並揭示抗氧化劑在癌細胞中可能具有的「雙面性」,未來若能精準操控這條代謝軸線,便有機會使癌細胞在壓力下走向自我毀滅,進而開發更有效的治療策略。
研究團隊透過癌症大數據分析發現,另一個關鍵分子SLC7A11扮演著「癌細胞後勤補給」的角色,負責穀胱甘肽的生成與供應,當SLC7A11表現量越高,癌細胞越能製造穀胱甘肽、抵抗鐵死亡,其表現亦與癌症惡性度及較差預後高度相關,研究因此提出「GSH–PKM2–SLC7A11」代謝軸線,作為未來精準癌症治療的重要研究方向。
研究結合了結構生物學、細胞實驗、動物腫瘤模型與癌症大數據分析等多元研究方法。其中,團隊成功解析丙酮酸激酶M2與穀胱甘肽結合的立體結構,首次揭開癌細胞關鍵蛋白「結構開關」的運作祕密。
研究成果亦受到國際學界肯定,在第19屆亞洲結晶學會議(AsCA 2025)榮獲 Rising Star Award,並於同步輻射研究中心第31屆用戶年會暨研討會獲頒「台灣之光獎」,陳粲然同時也是國內首位取得清華大學與大阪大學雙聯博士學位的學生,展現清華在跨國與跨領域研究人才培育上的長期投入與成果。
陳粲然表示,雙聯學位提供一個非常難得的機會,能夠深入參與不同實驗室的日常研究,並接觸結構生物學以及細胞影像等領域的多元技術,這樣的訓練也啟發他在研究時能有更靈活、多元的想法。
這項研究是跨領域、跨機構、跨國合作的成果,研究團隊長期與中研院院士兼台北醫學大學講座教授龔行健、陽明交通大學副校長楊慕華、副教授林峻宇、長庚大學教授鄭美玲,及日本大阪大學教授平岡泰、原口德子密切合作,共同參與由中研院院士洪明奇主持的國科會「T-Star台灣癌症尖端研究中心計畫」,攜手推動精準癌症治療相關研究。










